No campo da química, a toupeira é usada como uma unidade de medida, especificamente, é uma unidade de massa. Esta unidade permite referir-se ao número de átomos de uma substância. O conceito de toupeira pode ser aplicado tanto a átomos quanto a moléculas.
No campo da química, a toupeira é usada como uma unidade de medida, especificamente, é uma unidade de massa. Esta unidade permite referir-se ao número de átomos de uma substância. O conceito de toupeira pode ser aplicado tanto a átomos quanto a moléculas.
A toupeira como uma unidade é usada em química ou engenharia química. Outros conceitos relacionados são os seguintes: massa molecular, massa atômica, mol-grama e número de Avogadro.
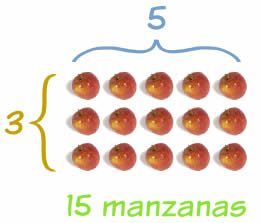
Para entender as reações químicas é necessário conhecer as partículas elementares da matéria. As partículas básicas são átomos, que diferem entre si. No entanto, essas diferenças são imperceptíveis, pois os átomos são muito pequenos.
Para facilitar esta tarefa, a seguinte abordagem pode ser iniciada: que cada tipo de átomo tenha uma massa diferente. Com este critério é possível distinguir os átomos comparando suas massas. Para obter essas informações, um sistema de proporções deve ser estabelecido entre os diferentes tipos de átomos. Em outras palavras, é necessário estabelecer a massa relativa dos átomos na forma de proporções. Para isso, no século 19, o químico italiano Amedeo Avogadro idealizou um sistema que ainda está em vigor e é conhecido como número de Avogadro ou constante.
O número de Avogadro permite especificar o número de átomos de uma substância
As unidades atômicas são difíceis de calcular. Devido a isso, Avogadro criou uma constante que nos permite estabelecer o número de átomos de uma substância. Assim, o número de Avogadro indica que 1 mol é igual a 6,022045 x 10 elevado a 23 partículas. Esse número permite englobar o conjunto de átomos de uma substância em um único bloco. Desse modo, na linguagem da química, pode-se falar de um mol de oxigênio combinado com um mol de carbono e ambos dão origem a um mol de CO. Nesse sentido, a constante de Avogadro permite reduzir drasticamente os cálculos em compostos químicos.
O que é massa molar ou massa atômica?
 A massa atômica é o número de prótons mais o número de nêutrons. Isso implica que a massa atômica é equivalente à massa física real de um átomo.
A massa atômica é o número de prótons mais o número de nêutrons. Isso implica que a massa atômica é equivalente à massa física real de um átomo.
Se a massa atômica do carbono é 12, isso equivale a dizer que um mol de átomos de carbono pesa 12 gramas. Dessa forma, é possível calcular o peso de um átomo ou o peso de meio mol. A massa molar é normalmente expressa em gramas / mol. Em outras palavras, quanto pesa 1 mol de um átomo.
Fotos: Fotolia - Photocreo Bednarek - Vege